Das Beer-Lambert-Gesetz (auch Beersches Gesetz genannt) ist eine Beziehung zwischen der Abschwächung von Licht durch eine Substanz und den Eigenschaften dieser Substanz. In diesem Blogbeitrag werden zunächst die Definitionen von Transmission und Absorption von Licht durch eine Substanz eingeführt, gefolgt von einer Erklärung des Beer-Lambert-Gesetzes.
Was sind Transmission und Absorption?
Betrachten Sie monochromatisches Licht, das durch eine Lösung transmittiert wird; mit einer einfallenden Intensität von I0 und einer transmittierten Intensität von I (Abbildung 1).
Der Transmissionsgrad T der Lösung ist definiert als das Verhältnis der transmittierten Intensität I zur einfallenden Intensität I0:
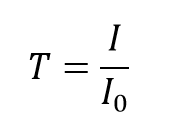
und nimmt Werte zwischen 0 und 1 an. Sie wird jedoch üblicherweise als prozentualer Transmissionsgrad ausgedrückt:
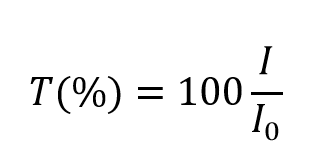
Der Absorptionsgrad A der Lösung ist mit dem Transmissionsgrad und den einfallenden und durchgelassenen Intensitäten durch die folgenden Beziehungen verbunden:
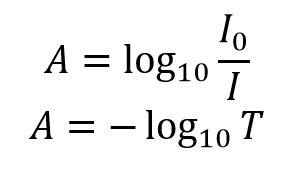
Die Extinktion steht in einem logarithmischen Verhältnis zum Transmissionsgrad, wobei eine Extinktion von 0 einem Transmissionsgrad von 100% und eine Extinktion von 1 einem Transmissionsgrad von 10% entspricht. Weitere Werte der Transmissions- und Absorptionspaarungen sind in Tabelle 1 angegeben. Eine visuelle Demonstration des Effekts, den die Absorption einer Lösung auf die Abschwächung des durch sie hindurchtretenden Lichts hat, zeigt Abbildung 2, in der ein 510-nm-Laser durch drei Lösungen von Rhodamin 6G mit unterschiedlicher Absorption geleitet wird.
Tabelle 1: Absorptions- und Transmissionswerte:
| Absorptionsgrad | Transmissionsgrad |
|---|---|
| 0 | 100% |
| 1 | 10% |
| 2 | 1% |
| 3 | 0.1% |
| 4 | 0,01% |
| 5 | 0.001% |

Abbildung 2: Abschwächung eines 510-nm-Lasers durch drei Lösungen von Rhodamin 6G mit unterschiedlichen Absorptionswerten bei 510 nm. Das gelbe Leuchten ist die Fluoreszenzemission bei ~560 nm.
Die Absorption ist eine dimensionslose Größe und sollte daher einheitenlos sein. Es ist jedoch üblich, dass hinter der Extinktion Einheiten von AU angegeben werden, die entweder für arbiträre Einheiten oder für Absorptionseinheiten stehen sollen. Diese Einheiten sind redundant und sollten vermieden werden. Eine weitere häufige Begegnung ist die Verwendung des Begriffs optische Dichte oder OD anstelle der Extinktion. Die optische Dichte ist ein älterer Begriff, der im Zusammenhang mit der Absorptionsspektroskopie gleichbedeutend mit der Extinktion ist; von der Verwendung der optischen Dichte anstelle der Extinktion wird jedoch von der IUPAC abgeraten.1
Was ist das Beer-Lambert-Gesetz?
Das Beer-Lambert-Gesetz ist eine lineare Beziehung zwischen der Absorption und der Konzentration, dem molaren Absorptionskoeffizienten und dem optischen Koeffizienten einer Lösung:

Der molare Absorptionskoeffizient ist eine probenabhängige Eigenschaft und ist ein Maß dafür, wie stark die Probe bei einer bestimmten Wellenlänge des Lichts absorbiert. Die Konzentration ist einfach die Mol L-1 (M) der Probe, die in der Lösung gelöst ist, und die Länge ist die Länge der Küvette, die für die Absorptionsmessung verwendet wird, und beträgt typischerweise 1 cm.
Das Beer-Lambert-Gesetz besagt, dass es eine lineare Beziehung zwischen der Konzentration und der Absorption der Lösung gibt, wodurch die Konzentration einer Lösung durch Messung ihrer Absorption berechnet werden kann. Um diese lineare Abhängigkeit zu demonstrieren, wurden fünf Lösungen von Rhodamin B in Wasser mit dem DS5 Zweistrahlspektralphotometer gemessen (Abbildung 3a) und aus diesen Absorptionsspektren wurde eine lineare Kalibrierkurve der Absorption gegen die Konzentration erstellt (Abbildung 3b). Mit Hilfe dieser Kalibrierungskurve kann die Konzentration einer unbekannten Rhodamin B-Lösung durch Messung der Absorption bestimmt werden, was der Hauptnutzen des Beer-Lambert-Gesetzes ist.
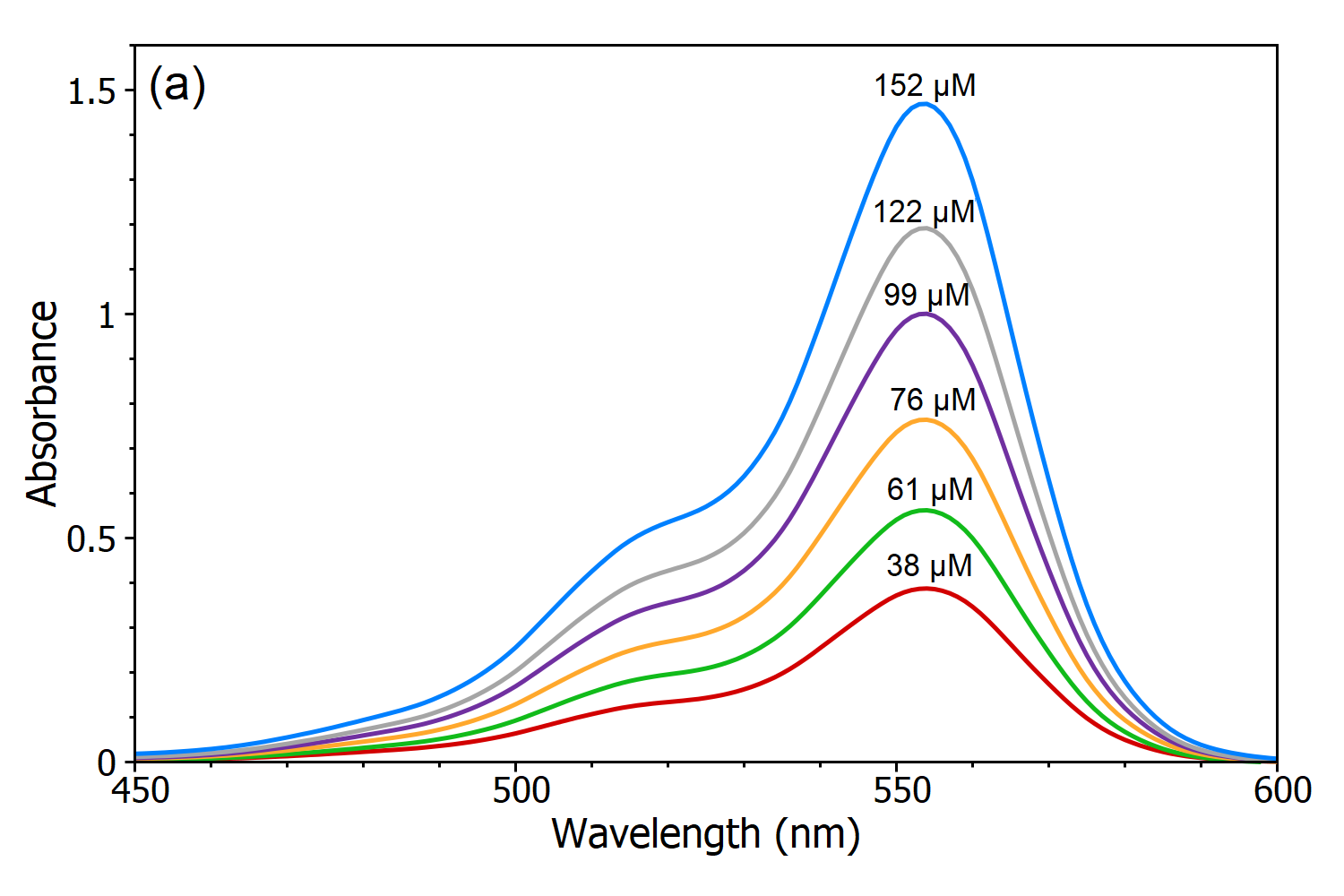

Abbildung 3 (a): Absorptionsspektren von Rhodamin B-Lösungen mit unterschiedlichen Konzentrationen in Wasser, gemessen mit dem DS5 Dual Beam Spectrophotometer. (b) Kalibrierungskurve von Rhodamin B in Wasser, gemessen bei λmax.
Weitere Informationen zur Theorie der Absorptionsspektroskopie finden Sie in der Rubrik „Häufig gestellte Fragen“ in unserem Blog.