Learning Outcomes
- Identifizieren Sie Typen von Rezeptoren, ihre molekulare Zusammensetzung und die Unterschiede zwischen ihnen
Rezeptoren sind Proteinmoleküle in der Zielzelle oder auf ihrer Oberfläche, die Liganden binden. Es gibt zwei Arten von Rezeptoren, interne Rezeptoren und Zelloberflächenrezeptoren.
Interne Rezeptoren

Abbildung 1. Hydrophobe Signalmoleküle diffundieren typischerweise durch die Plasmamembran und interagieren mit intrazellulären Rezeptoren im Zytoplasma. Viele intrazelluläre Rezeptoren sind Transkriptionsfaktoren, die mit der DNA im Zellkern interagieren und die Genexpression regulieren.
Interne Rezeptoren, auch als intrazelluläre oder zytoplasmatische Rezeptoren bezeichnet, befinden sich im Zytoplasma der Zelle und reagieren auf hydrophobe Ligandenmoleküle, die die Plasmamembran durchqueren können. Einmal in der Zelle angekommen, binden viele dieser Moleküle an Proteine, die als Regulatoren der mRNA-Synthese (Transkription) wirken, um die Genexpression zu vermitteln. Die Genexpression ist der zelluläre Prozess, bei dem die Information in der DNA einer Zelle in eine Sequenz von Aminosäuren umgewandelt wird, die schließlich ein Protein bildet. Wenn der Ligand an den internen Rezeptor bindet, wird eine Konformationsänderung ausgelöst, die eine DNA-Bindungsstelle auf dem Protein freilegt. Der Ligand-Rezeptor-Komplex wandert in den Zellkern, bindet dann an spezifische regulatorische Regionen der chromosomalen DNA und fördert die Initiierung der Transkription (Abbildung 1). Die Transkription ist der Prozess des Kopierens der Informationen in der DNA einer Zelle in eine spezielle Form der RNA, die Boten-RNA (mRNA) genannt wird; die Zelle verwendet die Informationen in der mRNA (die sich ins Zytoplasma bewegt und mit Ribosomen assoziiert), um bestimmte Aminosäuren in der richtigen Reihenfolge zu verknüpfen und ein Protein zu produzieren. Interne Rezeptoren können die Genexpression direkt beeinflussen, ohne das Signal an andere Rezeptoren oder Botenstoffe weitergeben zu müssen.
Zelloberflächenrezeptoren
Zelloberflächenrezeptoren, auch Transmembranrezeptoren genannt, sind membranverankerte (integrale) Proteine der Zelloberfläche, die an externe Ligandenmoleküle binden. Diese Art von Rezeptoren überspannt die Plasmamembran und führt eine Signaltransduktion durch, bei der ein extrazelluläres Signal in ein interzelluläres Signal umgewandelt wird. Liganden, die mit Zelloberflächenrezeptoren interagieren, müssen nicht in die Zelle eindringen, die sie beeinflussen. Zelloberflächenrezeptoren werden auch als zellspezifische Proteine oder Marker bezeichnet, da sie spezifisch für einzelne Zelltypen sind.
Jeder Zelloberflächenrezeptor hat drei Hauptkomponenten: eine externe ligandenbindende Domäne, eine hydrophobe membranüberspannende Region und eine intrazelluläre Domäne innerhalb der Zelle. Die ligandenbindende Domäne wird auch als extrazelluläre Domäne bezeichnet. Die Größe und Ausdehnung jeder dieser Domänen variiert stark, je nach Art des Rezeptors.
Da Rezeptorproteine an der Zelloberfläche für die normale Zellfunktion grundlegend sind, sollte es nicht überraschen, dass eine Fehlfunktion in einem dieser Proteine schwerwiegende Folgen haben kann. Fehler in den Proteinstrukturen bestimmter Rezeptormoleküle spielen nachweislich eine Rolle bei Bluthochdruck, Asthma, Herzkrankheiten und Krebs.
Wie Viren einen Wirt erkennen
Im Gegensatz zu lebenden Zellen haben viele Viren keine Plasmamembran oder andere Strukturen, die zur Aufrechterhaltung des Lebens notwendig sind. Einige Viren bestehen einfach aus einer inerten Proteinhülle, die DNA oder RNA enthält. Um sich zu vermehren, müssen Viren in eine lebende Zelle eindringen, die als Wirt dient, und dann den zellulären Apparat des Wirts übernehmen. Aber wie erkennt ein Virus seinen Wirt?
Viren binden oft an Zelloberflächenrezeptoren der Wirtszelle. Zum Beispiel bindet das Virus, das die menschliche Grippe (Influenza) verursacht, spezifisch an Rezeptoren auf Membranen von Zellen des Atmungssystems. Chemische Unterschiede in den Zelloberflächenrezeptoren zwischen den Wirten bedeuten, dass ein Virus, das eine bestimmte Spezies (z. B. den Menschen) infiziert, eine andere Spezies (z. B. Hühner) nicht infizieren kann.
Viren haben jedoch im Vergleich zum Menschen nur sehr geringe Mengen an DNA oder RNA, so dass die virale Reproduktion schnell erfolgen kann. Bei der viralen Vermehrung kommt es immer wieder zu Fehlern, die zu Veränderungen in den neu produzierten Viren führen können; diese Veränderungen bedeuten, dass sich die viralen Proteine, die mit Zelloberflächenrezeptoren interagieren, so entwickeln können, dass sie an Rezeptoren in einem neuen Wirt binden können. Solche Veränderungen passieren zufällig und recht häufig im Reproduktionszyklus eines Virus, aber die Veränderungen spielen nur dann eine Rolle, wenn ein Virus mit neuen Bindungseigenschaften mit einem geeigneten Wirt in Kontakt kommt. Im Falle der Influenza kann diese Situation in Umgebungen auftreten, in denen Tiere und Menschen in engem Kontakt stehen, wie zum Beispiel in Geflügel- und Schweinefarmen. Sobald ein Virus auf einen neuen Wirt überspringt, kann es sich schnell verbreiten. Wissenschaftler beobachten neu auftretende Viren (sogenannte Emerging Viruses) genau, in der Hoffnung, dass eine solche Überwachung die Wahrscheinlichkeit globaler Virusepidemien verringern kann.
Zelloberflächenrezeptoren sind an den meisten Signalübertragungen in multizellulären Organismen beteiligt. Es gibt drei allgemeine Kategorien von Zelloberflächenrezeptoren: Rezeptoren, die an Ionenkanäle gebunden sind, Rezeptoren, die an G-Proteine gebunden sind, und Rezeptoren, die an Enzyme gebunden sind.

Abbildung 2. Gated Ion Channels bilden eine Pore durch die Plasmamembran, die sich öffnet, wenn das Signalmolekül bindet. Die offene Pore erlaubt dann Ionen, in die Zelle hinein oder aus ihr heraus zu fließen.
Ionenkanalgebundene Rezeptoren binden einen Liganden und öffnen einen Kanal durch die Membran, der bestimmte Ionen passieren lässt. Um einen Kanal zu bilden, hat dieser Typ von Zelloberflächenrezeptoren einen ausgedehnten membranüberspannenden Bereich. Um mit den Phospholipid-Fettsäureschwänzen, die das Zentrum der Plasmamembran bilden, interagieren zu können, sind viele der Aminosäuren in der membranüberspannenden Region von Natur aus hydrophob. Umgekehrt sind die Aminosäuren, die das Innere des Kanals auskleiden, hydrophil, um den Durchgang von Wasser oder Ionen zu ermöglichen. Wenn ein Ligand an die extrazelluläre Region des Kanals bindet, kommt es zu einer Konformationsänderung in der Proteinstruktur, die es Ionen wie Natrium, Kalzium, Magnesium und Wasserstoff ermöglicht, den Kanal zu passieren (Abbildung 2).
G-Protein-gebundene Rezeptoren binden einen Liganden und aktivieren ein Membranprotein, das als G-Protein bezeichnet wird. Das aktivierte G-Protein interagiert dann entweder mit einem Ionenkanal oder einem Enzym in der Membran (Abbildung 3). Alle G-Protein-verknüpften Rezeptoren haben sieben Transmembrandomänen, aber jeder Rezeptor hat seine eigene spezifische extrazelluläre Domäne und G-Protein-Bindungsstelle.
Die Zellsignalisierung durch G-Protein-verknüpfte Rezeptoren erfolgt in einer zyklischen Reihe von Ereignissen. Bevor der Ligand bindet, kann das inaktive G-Protein an eine neu entdeckte, für seine Bindung spezifische Stelle auf dem Rezeptor binden. Sobald das G-Protein an den Rezeptor bindet, aktiviert die daraus resultierende Formveränderung das G-Protein, das GDP freisetzt und GTP aufnimmt. Die Untereinheiten des G-Proteins spalten sich daraufhin in die α-Untereinheit und die βγ-Untereinheit. Eines oder beide dieser G-Protein-Fragmente können in der Folge andere Proteine aktivieren. Nach einer Weile wird das GTP an der aktiven α-Untereinheit des G-Proteins zu GDP hydrolysiert und die βγ-Untereinheit wird deaktiviert. Die Untereinheiten reassoziieren zum inaktiven G-Protein und der Zyklus beginnt von neuem.
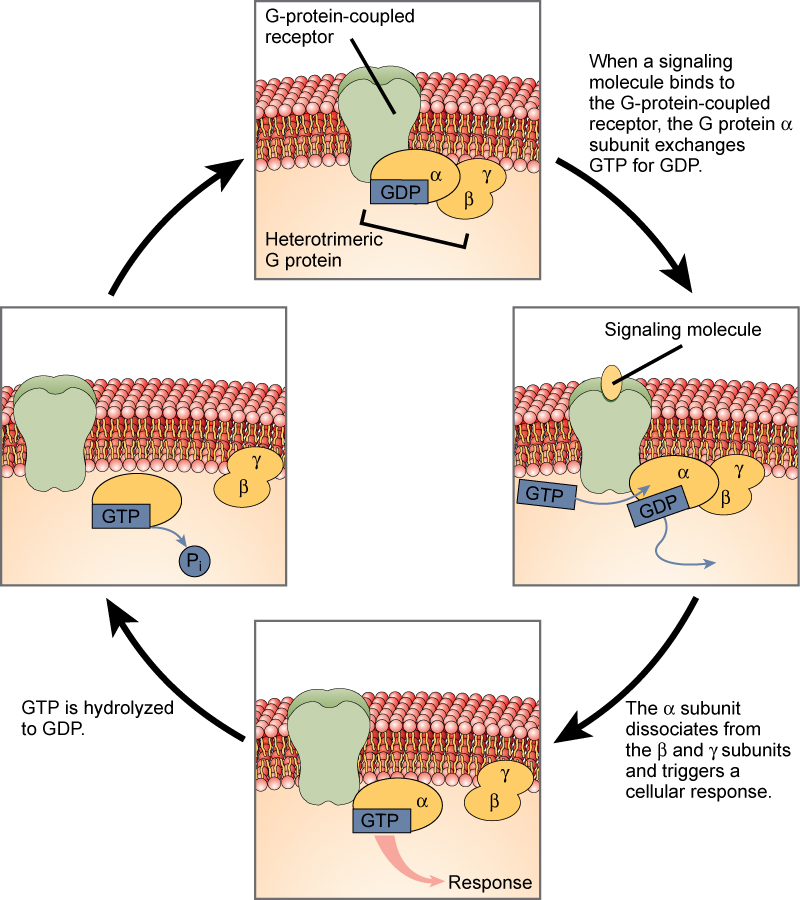
Abbildung 3. Heterotrimere G-Proteine haben drei Untereinheiten: α, β und γ. Wenn ein Signalmolekül an einen G-Protein-gekoppelten Rezeptor in der Plasmamembran bindet, wird ein mit der α-Untereinheit assoziiertes GDP-Molekül gegen GTP ausgetauscht. Die β- und γ-Untereinheiten dissoziieren von der α-Untereinheit, und eine zelluläre Antwort wird entweder durch die α-Untereinheit oder das dissoziierte βγ-Paar ausgelöst. Die Hydrolyse von GTP zu GDP beendet das Signal.
G-Protein-verknüpfte Rezeptoren sind ausgiebig untersucht worden und man hat viel über ihre Rolle bei der Erhaltung der Gesundheit gelernt. Für den Menschen pathogene Bakterien können Gifte freisetzen, die die Funktion bestimmter G-Protein-verknüpfter Rezeptoren unterbrechen und zu Krankheiten wie Keuchhusten, Botulismus und Cholera führen.

Abbildung 4. Cholera wird hauptsächlich durch verunreinigtes Trinkwasser übertragen und ist eine der Haupttodesursachen in den Entwicklungsländern und in Gebieten, in denen Naturkatastrophen die Verfügbarkeit von sauberem Wasser unterbrechen. (credit: New York City Sanitary Commission)
Bei der Cholera (Abbildung 4) zum Beispiel produziert das durch Wasser übertragene Bakterium Vibrio cholerae ein Toxin, Choleragen, das sich an Zellen bindet, die den Dünndarm auskleiden. Das Toxin dringt dann in diese Darmzellen ein, wo es ein G-Protein verändert, das die Öffnung eines Chloridkanals steuert, und bewirkt, dass dieser ständig aktiv bleibt, was zu großen Flüssigkeitsverlusten aus dem Körper und einer potenziell tödlichen Dehydrierung führt.
Moderne sanitäre Einrichtungen beseitigen die Gefahr von Choleraausbrüchen, wie dem, der 1866 in New York City grassierte. Dieses Poster aus dieser Zeit zeigt, dass man damals noch nicht verstand, wie die Krankheit übertragen wurde.
Enzymgebundene Rezeptoren sind Zelloberflächenrezeptoren mit intrazellulären Domänen, die mit einem Enzym assoziiert sind. In einigen Fällen ist die intrazelluläre Domäne des Rezeptors selbst ein Enzym. Andere enzyme-linked receptors haben eine kleine intrazelluläre Domäne, die direkt mit einem Enzym interagiert. Die enzymgekoppelten Rezeptoren haben normalerweise große extrazelluläre und intrazelluläre Domänen, aber die membranüberspannende Region besteht aus einer einzigen alpha-helicalen Region des Peptidstrangs. Wenn ein Ligand an die extrazelluläre Domäne bindet, wird ein Signal durch die Membran übertragen und das Enzym aktiviert. Die Aktivierung des Enzyms setzt eine Kette von Ereignissen innerhalb der Zelle in Gang, die schließlich zu einer Reaktion führt. Ein Beispiel für diese Art von enzymgekoppeltem Rezeptor ist der Tyrosinkinase-Rezeptor (Abbildung 5). Eine Kinase ist ein Enzym, das Phosphatgruppen von ATP auf ein anderes Protein überträgt. Der Tyrosinkinase-Rezeptor überträgt Phosphatgruppen auf Tyrosinmoleküle (Tyrosinreste). Zunächst binden Signalmoleküle an die extrazelluläre Domäne von zwei benachbarten Tyrosinkinase-Rezeptoren. Die beiden benachbarten Rezeptoren binden dann aneinander, oder dimerisieren. Anschließend werden Phosphate an Tyrosinreste auf der intrazellulären Domäne der Rezeptoren angefügt (Phosphorylierung). Die phosphorylierten Reste können dann das Signal an den nächsten Botenstoff im Zytoplasma weiterleiten.
Praxisfrage

Abbildung 5. Eine Rezeptortyrosinkinase ist ein enzymgekoppelter Rezeptor mit einer einzelnen Transmembranregion und extrazellulären und intrazellulären Domänen. Die Bindung eines Signalmoleküls an die extrazelluläre Domäne führt zur Dimerisierung des Rezeptors. Tyrosinreste auf der intrazellulären Domäne werden dann autophosphoryliert und lösen eine nachgeschaltete zelluläre Antwort aus. Das Signal wird durch eine Phosphatase beendet, die die Phosphate von den Phosphotyrosinresten entfernt.
HER2 ist eine Rezeptortyrosinkinase. Bei 30 Prozent der menschlichen Brustkrebse ist HER2 dauerhaft aktiviert, was zu einer unregulierten Zellteilung führt. Lapatinib, ein Medikament zur Behandlung von Brustkrebs, hemmt die Autophosphorylierung der HER2-Rezeptor-Tyrosin-Kinase (der Prozess, bei dem der Rezeptor Phosphate an sich selbst anhängt) und reduziert so das Tumorwachstum um 50 Prozent. Welcher der folgenden Schritte, außer der Autophosphorylierung, wird durch Lapatinib gehemmt?
- Signalmolekülbindung, Dimerisierung und die nachgeschaltete zelluläre Antwort
- Dimerisierung, und die nachgeschaltete zelluläre Antwort
- Die nachgeschaltete zelluläre Antwort
- Phosphatase-Aktivität, Dimerisierung und die nachgeschaltete zelluläre Antwort
Versuchen Sie es
Beitragen!
Verbessern Sie diese SeiteMehr erfahren