Aminoglykoside zeigen konzentrationsabhängige bakterizide Aktivität gegen „die meisten gramnegativen aeroben und fakultativ anaeroben Bazillen“, aber nicht gegen gramnegative Anaerobier und die meisten grampositiven Bakterien. Sie benötigen nur eine kurze Kontaktzeit und sind am effektivsten gegen anfällige Bakterienpopulationen, die sich schnell vermehren. Diese Aktivitäten werden auf eine primäre Wirkungsweise als Proteinsynthese-Inhibitoren zurückgeführt, obwohl für einige spezifische Wirkstoffe zusätzliche Mechanismen vermutet werden und/oder gründliche mechanistische Beschreibungen noch nicht verfügbar sind.
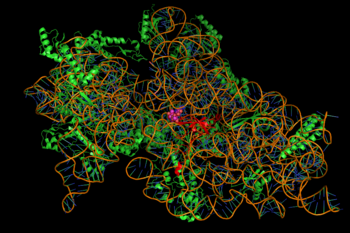
Die Hemmung der Proteinsynthese wird durch die energieabhängige, manchmal irreversible Bindung der Aminoglykoside an das zytosolische, membranassoziierte bakterielle Ribosom (Bild rechts) vermittelt. (Aminoglykoside durchqueren zuerst die bakterielle Zellwand – Lipopolysaccharid in gramnegativen Bakterien – und die Zellmembran, wo sie aktiv transportiert werden.) Während die spezifischen Schritte in der Proteinsynthese, die betroffen sind, zwischen den einzelnen Aminoglykosidwirkstoffen etwas variieren können, ebenso wie ihre Affinität und ihr Bindungsgrad, stört die Anwesenheit von Aminoglykosiden im Zytosol im Allgemeinen die Peptidverlängerung an der 30S ribosomalen Untereinheit, was zu einer ungenauen mRNA-Translation und damit zur Biosynthese von Proteinen führt, die abgeschnitten sind oder an bestimmten Stellen eine veränderte Aminosäurezusammensetzung aufweisen. Insbesondere beeinträchtigt die Bindung die Translationskorrektur, was zu einem falschen Lesen der RNA-Botschaft, einer vorzeitigen Terminierung oder beidem und damit zu einer Ungenauigkeit des translatierten Proteinprodukts führt. Die Teilmenge der aberranten Proteine, die in die bakterielle Zellmembran eingebaut werden, können dann zu Veränderungen ihrer Permeabilität und damit zu einer „weiteren Stimulation des Aminoglykosid-Transports“ führen. Der Aminozuckeranteil dieser Molekülklasse (z.B. das 2-Desoxystreptamin in Kanamycinen, Gentamicinen und Tobramycin, s.o.) ist an der Assoziation des kleinen Moleküls mit ribosomalen Strukturen beteiligt, die zu den Untreuefällen bei der Translation führen (ebd.). Eine Hemmung der ribosomalen Translokation – d. h. der Bewegung der Peptidyl-tRNA von der A- zur P-Seite – wurde ebenfalls vorgeschlagen. Kürzlich durchgeführte Einzelmolekül-Tracking-Experimente in lebenden E. coli zeigten eine laufende, aber verlangsamte Proteinsynthese bei Behandlung mit verschiedenen Aminoglykosid-Medikamenten. (Spectinomycin, eine verwandte, aber andere chemische Strukturklasse, die oft mit Aminoglykosiden diskutiert wird, induziert kein mRNA-Fehllesen und ist im Allgemeinen nicht bakterizid.)
Schließlich tritt auch ein weiterer „Zellmembran-Effekt“ bei Aminoglykosiden auf; die „funktionelle Integrität der bakteriellen Zellmembran“ kann verloren gehen, später im Zeitverlauf der Aminoglykosid-Exposition und des Transports.
Pharmakokinetik und Pharmakodynamik
Es gibt eine signifikante Variabilität in der Beziehung zwischen der verabreichten Dosis und dem resultierenden Plasmaspiegel im Blut. Therapeutisches Drug Monitoring (TDM) ist notwendig, um die richtige Dosis zu erhalten. Diese Wirkstoffe zeigen eine post-antibiotische Wirkung, bei der kein oder nur ein sehr geringer Wirkstoffspiegel im Blut nachweisbar ist, aber dennoch eine Hemmung des bakteriellen Neuwachstums zu bestehen scheint. Dies ist auf eine starke, irreversible Bindung an das Ribosom zurückzuführen und verbleibt intrazellulär, lange nachdem die Plasmaspiegel gesunken sind, und ermöglicht ein verlängertes Dosierungsintervall. Je nach Konzentration wirken sie bakteriostatisch oder bakterizid.
Indikationen
Aminoglykoside sind vor allem bei Infektionen mit aeroben, gramnegativen Bakterien, wie Pseudomonas, Acinetobacter und Enterobacter, nützlich. Darüber hinaus sind einige Mykobakterien, einschließlich der Bakterien, die Tuberkulose verursachen, empfindlich gegenüber Aminoglykosiden. Streptomycin war das erste wirksame Medikament bei der Behandlung von Tuberkulose, obwohl die Rolle der Aminoglykoside wie Streptomycin und Amikacin (wegen ihrer Toxizität und unbequemen Verabreichungsart) in den Hintergrund getreten ist, außer bei mehrfach resistenten Stämmen. Der häufigste Einsatz von Aminoglykosiden ist die empirische Therapie bei schweren Infektionen wie Sepsis, komplizierten intraabdominalen Infektionen, komplizierten Harnwegsinfektionen und nosokomialen Infektionen der Atemwege. In der Regel werden Aminoglykoside nach Anlegen von Kulturen des verursachenden Organismus und Prüfung der Empfindlichkeit zugunsten von weniger toxischen Antibiotika abgesetzt.
Wie bereits erwähnt, sind Aminoglykoside gegen anaerobe Bakterien, Pilze und Viren meist unwirksam. Infektionen, die durch Gram-positive Bakterien verursacht werden, können ebenfalls mit Aminoglykosiden behandelt werden, aber andere Arten von Antibiotika sind wirksamer und weniger schädlich für den Wirt. In der Vergangenheit wurden die Aminoglykoside wegen ihrer synergistischen Wirkung zusammen mit Beta-Lactam-Antibiotika bei Streptokokken-Infektionen eingesetzt, insbesondere bei Endokarditis. Eine der häufigsten Kombinationen ist Ampicillin (ein Beta-Lactam- oder Penicillin-verwandtes Antibiotikum) und Gentamicin. Oft bezeichnet das Krankenhauspersonal diese Kombination als „Amp und Gent“ oder neuerdings als „Pen und Gent“ für Penicillin und Gentamicin.
Nonsense-Suppression
Die Störung der mRNA-Korrekturlesung wurde ausgenutzt, um genetische Krankheiten zu behandeln, die aus vorzeitigen Stoppcodons resultieren (was zu einer frühen Beendigung der Proteinsynthese und verkürzten Proteinen führt). Aminoglykoside können die Zelle veranlassen, die Stoppcodons zu überwinden, eine zufällige Aminosäure einzufügen und ein Protein in voller Länge zu exprimieren. Das Aminoglykosid Gentamicin wurde zur Behandlung von Mukoviszidose (CF)-Zellen im Labor verwendet, um sie zur Bildung von Proteinen in voller Länge zu veranlassen. Mukoviszidose wird durch eine Mutation in dem Gen verursacht, das für das CFTR-Protein (Cystic Fibrosis Transmembrane Conductance Regulator) kodiert. In etwa 10 % der CF-Fälle führt die Mutation in diesem Gen zu einer vorzeitigen Terminierung während der Translation, was zur Bildung eines verkürzten und nicht funktionsfähigen CFTR-Proteins führt. Es wird angenommen, dass Gentamicin die Struktur des Ribosom-RNA-Komplexes verzerrt, was zu einer Fehllesung des Terminationscodons führt, wodurch das Ribosom die Stoppsequenz „überspringt“ und mit der normalen Elongation und Produktion des CFTR-Proteins fortfährt.