Leitfähigkeit
Eine weitere charakteristische Eigenschaft ionischer Verbindungen ist ihre elektrische Leitfähigkeit. Die folgende Abbildung zeigt drei Experimente, bei denen zwei Elektroden, die mit einer Glühbirne verbunden sind, in Bechergläser mit drei verschiedenen Substanzen gestellt werden.
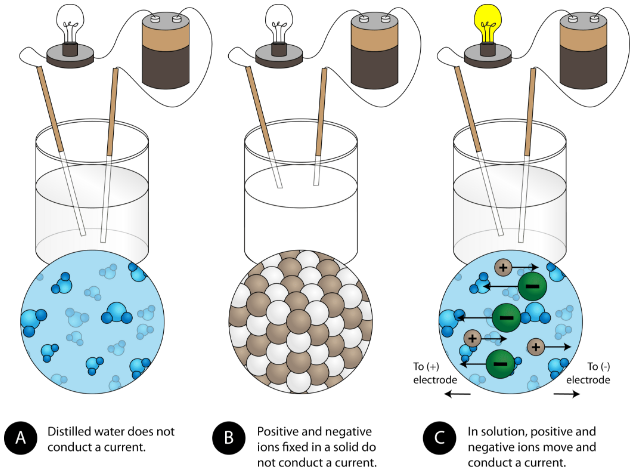
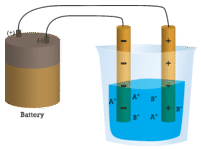
Im ersten Becherglas leitet destilliertes Wasser keinen Strom, da Wasser eine molekulare Verbindung ist. Im zweiten Becherglas leitet das feste Natriumchlorid ebenfalls keinen Strom. Obwohl es ionisch ist und somit aus geladenen Teilchen besteht, können sich die Ionen aufgrund des festen Kristallgitters nicht zwischen den Elektroden bewegen. Damit der Stromkreis geschlossen ist und die Glühbirne leuchtet, werden bewegliche geladene Teilchen benötigt. Im dritten Becherglas wurde das NaCl im destillierten Wasser gelöst. Nun ist das Kristallgitter aufgebrochen und die einzelnen positiven und negativen Ionen können sich bewegen. Die Kationen bewegen sich zu einer Elektrode, die Anionen zur anderen, so dass Strom fließen kann (siehe Abbildung unten). Durch das Schmelzen einer ionischen Verbindung werden auch die Ionen frei, um einen Strom zu leiten. Ionische Verbindungen leiten einen elektrischen Strom, wenn sie geschmolzen oder in Wasser aufgelöst werden. Das Lösen von ionischen Verbindungen in Wasser wird in Abschnitt 9.3 behandelt.
Beispiel \(\PageIndex{1}\)
Schreiben Sie die Dissoziationsgleichung von festem NaCl in Wasser.
Lösung
NaCl(s) → Na+(aq) + Cl-(aq)
Übung \(\PageIndex{1}\)
Schreiben Sie die Dissoziationsgleichung von festem NH4NO3 in Wasser.
Antwort
NH4NO3(s) → NH4+(aq) + NO3-(aq)